分子間力
概要
「分子間力」とは、分子間に働く引力のこと。全ての分子の間には必ず分子間力が働きます。分子間力は大きく分けてファンデルワールス力・極性による力・水素結合などの種類があります。

もし分子間力がなければ、分子は自由気ままに飛び回る気体になりますが、分子間力があることによって液体や固体になることもできます。
詳細
一口に分子間力と言っても、引力が働く原因はさまざまあり、その原因によってファンデルワールス力・極性による力・水素結合などの呼び名があります。
ファンデルワールス力
ファンデルワールス力は、全ての分子間に働く非常に弱い引力です。極性による力や水素結合に比べても格段に弱い力です。酸素

ファンデルワールス力の原因は激ムズなので知らなくていいですが、ざっくりいうなら分子内の確率的な電子の偏りが原因で生まれる力です。
電子殻にある電子といえど位置がランダムにずれることがあり、瞬間的に分子内でわずかな電荷の偏りが生じます(*注)。この電荷が静電気的に引き合って力が生じるわけです。ただし、そもそも偏りがわずかであること、偏るのは瞬間的であることなどから非常に弱い力です。
極性による力
「極性」がある分子は、極性による電荷の偏りで引き合います。極性がわからない場合は上のリンクをチェック!
たとえば塩化水素

水素結合
超電子大好き元素
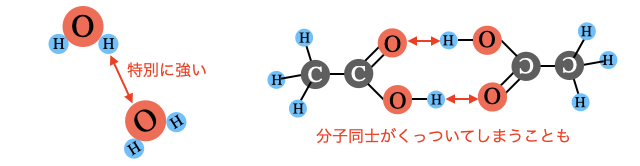
普通に極性分子が近寄っても引力を感じる程度ですが、極性が強すぎる分子が近寄ると磁石がくっついたように自然には剥がれなくなる場合があります。このように極性で結合ができてしまうので、水素結合と特別に名前が付いているわけです。
細かすぎる補足
- (*注)相当遠回りにはなりますが、ほんの少しだけファンデルワールス力の説明をしておきます。量子力学によれば電子などの小さすぎる粒子はある一点に存在するわけではなく、ある領域に確率的に存在しています。言ってる意味がわからないのは正常な人間である証拠です。だいたいどこにいるかはわかるけど、実際に見てみるまで具体的には場所がわかりません。 例え話も難しいですが無理やり例えるならスイクンみたいな感じ。マップのどこかには必ずいるけど、実際に観測してみるまでどこにいるかはわからないし、次の瞬間にどこにいくかも予測できません。ポケモンがわからない人はすいません。 いっそのこと電子は熱振動していると考えてしまってもいいですが、仮に絶対零度だとしても(程度の違いはあれ)この性質は変わらないことに注意が必要です。とにかく確率的に居場所が変わるイメージです。 ついにファンデルワールス力の説明に移ります。原子内には複数の電子があり、そのそれぞれが確率的に居場所が変わります。これによって1粒の原子の中でも確率的な電荷の偏りが生じるわけです。これがファンデルワールス力の原因(の一つ)であり、「ロンドン分散力」と呼ばれる力です。実際に計算をしてみるとロンドン分散力は分子間距離の6乗に反比例するほど小さい力です。
- 以上の説明からファンデルワールス力は全ての分子に働くことがわかると思います。ちなみに特殊な場合を考えればファンデルワールス力の原因はこれだけではありません。たとえば無極性分子に極性分子が近づくと、無極性分子内の電子が引っ張られて電荷が偏ります。これによって生じる力もファンデルワールス力の1つです。...とまあ言い出すとキリがないのでこのくらいにしておきます。
